Bara en undertyp av fettcell reagerar på insulin hos människa
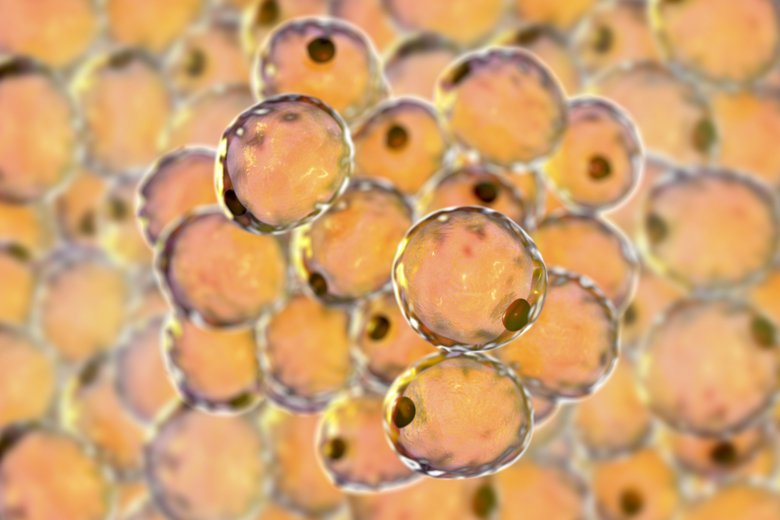
Att fettceller kan påverka vår känslighet för insulin är känt sedan tidigare. Nu har forskare vid Karolinska Institutet kommit fram till att det finns tre olika undertyper av mogna fettceller i vit fettvävnad. En av dessa, kallad AdipoPLIN, reagerar särskilt på insulin och kan vara relevant för framtida behandlingar av metabola folksjukdomar som typ 2 diabetes.

– Dessa fynd ökar kunskapen om fettvävens funktion. De visar att fettvävens kapacitet att regleras av insulin bestäms av andelen och funktionen hos en specifik undertyp av fettceller, vilket kan ha betydelse för sjukdomar som fetma, insulinresistens och typ 2 diabetes, säger Niklas Mejhert, forskare vid institutionen för medicin, Huddinge, på Karolinska Institutet och en av studiens korresponderande författare.
I studien, som publicerats i tidskriften Cell Metabolism, har forskarna identifierat 18 cellklasser som bildar kluster i vit fettvävnad hos människa. Av dessa utgjorde tre klasser mogna fettceller med distinkta fenotyper.
För att testa om fettcellstyperna var kopplade till någon specifik funktion studerade forskarna bland annat hur dessa undertyper reagerade på ökade insulinnivåer genom att injicera insulin hos fyra personer. Resultatet visade att insulin aktiverade genuttrycket i undertypen AdipoPLIN men påverkade inte de andra två undertyperna. Svaret på insulinstimuleringen var dessutom proportionell mot individens insulinkänslighet.
Utmanar synen på insulinkänslighet

– Våra fynd utmanar den nuvarande synen på störningar i insulinkänslighet som ett generellt reducerat insulinsvar i vävnadens fettceller. Vår studie tyder snarare på att insulinresistens, och möjligen typ 2 diabetes, kan bero på förändringar i en särskild sorts fettceller. Detta visar att fettväven är en mycket mer komplex vävnad än vad man hittills trott. I likhet med muskelvävnad har människor flera fettcellstyper med olika funktion vilket öppnar upp för framtida interventioner riktade mot de olika fettcellstyperna, säger Mikael Rydén, professor vid samma institution och en av studiens korresponderande författare.
I studien har Rydén och Mejhert gruppen använt en speciell teknik, så kallad spatiell transkriptomik, som bland annat utvecklats av samarbetspartnern Patrik Ståhl, universitetslektor vid KTH och SciLifeLab. Spatiell transkriptomik genererar information om vävnadens utseende via mikroskopi och genexpression via RNA sekvensering.

– Studien där vi applicerat spatiell transkriptomik på fettvävnad är helt unik givet vävnadens speciella karaktär och sammansättning. Vi är väldigt glada att tekniken fortsätter bidra till att lösa biologiskt komplexa frågeställningar i ett ökande antal forskningsområden, säger Patrik Ståhl, studiens tredje korresponderande författare.
Forskningen har finansierats av donationer från Margareta af Ugglas stiftelse, Knut & Alice Wallenbergs stiftelse, Vetenskapsrådet, ERC-SyG SPHERES, NovoNordisk Fonden, MSAM konsortiet, MeRIAD konsortiet, CIMED, Diabetesförbundet, Region Stockholm, Familjen Erling-Perssons stiftelse och det strategiska forskningsprogrammet i diabetes på Karolinska Institutet.
Patrik Ståhl, Nayanika Bhalla och Alma Andersson är rådgivare till 10x Genomics som äger rättigheterna till den spatiella transkriptomikteknologin. Lovisa Franzén är anställd hos Astra Zeneca. Inga andra intressekonflikter har rapporterats.
Publikation
”Spatial Mapping Reveals Human Adipocyte Subpopulations with Distinct Sensitivities to Insulin,” Jesper Bäckdahl, Lovisa Franzén, Lucas Massier, Qian Li, Jutta Jalkanen, Hui Gao, Alma Andersson, Nayanika Bhalla, Anders Thorell, Mikael Rydén, Patrik L. Ståhl, Niklas Mejhert, Cell Metabolism, online 10 augusti, 2021, doi: 10.1016/j.cmet.2021.07.018
