Cryo-EM möter uromodulin, vår beskyddare mot urinvägsinfektioner

Vad har försvaret mot bakterieinfektioner gemensamt med hörsel eller befruktning? Nyckelaktörerna i dessa och många andra viktiga biologiska processer tillhör en stor familj av extracellulära proteiner med en gemensam polymerisationsmotor som kallas "Zona pellucida (ZP) module". Detaljerad information om hur dessa ZP-modulproteiner ser ut i deras funktionella polymera tillstånd har hittills varit svårfångad. Nu har forskare vid KI äntligen belyst denna långvariga fråga.
På grund av deras breda evolutionära bevarande och stora biomedicinska betydelse för människor har dessa molekyler varit fokus för tusentals studier under de senaste 30 åren; emellertid har uppbyggnaden av de filament som bildas av dessa proteiner varit okänd. Genom att använda sig av de senaste framstegen inom kryo-elektronmikroskopi (Cryo-EM) - en teknik som tilldelades Nobelpriset i kemi 2017 - har forskare vid Karolinska Institutet äntligen belyst denna fråga.
Studien, som först rapporterades i bioRxiv den 28 maj, 2020, publicerades i måndags i The EMBO Journal.
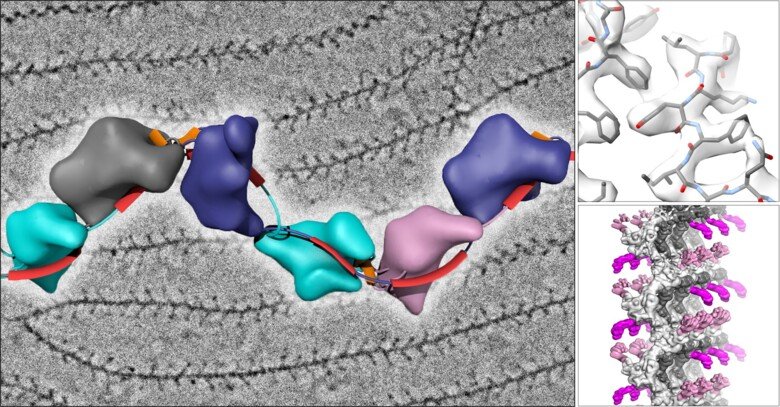
En forskargrupp som leds av Luca Jovine, professor i strukturbiologi vid Institutionen för biovetenskaper och näringslära vid KI, har använt Cryo-EM för att avbilda den trådlika strukturen av uromodulin (UMOD) / Tamm-Horsfall-protein, en molekyl som skyddar urinvägarna från infektion genom att fungera som ett lockbete för uropatogena bakterier. Cryo-EM-rekonstruktion av naturliga humana UMOD-filament avslöjade att proteinet dramatiskt förändrar sin form under polymerisationen. Detta gör att flera kopior av UMOD kan kopplas samman med varandra och bilda en mycket stabil polymer som inte liknar något annat känt biologiskt filament. Det är anmärkningsvärt att direkt Cryo-EM-analys av mänsklig urin antyder att UMOD-filament ansamlas i kardborreliknande ark som exponerar ett stort antal bindningsställen för att effektivt fånga in uropatogena bakterier.
"Vårt arbete föreslår också att filamenten som utgör äggets extracellulära beläggning använder en mycket liknande struktur som UMOD", säger Luca Jovine. "Således skulle kanske en jämförbar molekylär strategi kunna användas av ägget för att binda spermier i början av befruktningen. Detta belyser vikten av att komplettera klassiska studier av enskilda äggbeläggningskomponenter med undersökningar av deras trådlika sammansättning, vilket är det faktiska material som spermier påverkar varandra med."

Studien, baserad på data insamlat tillsammans med Dr Marta Carroni vid SciLifeLab cryo-EM National Facility i Stockholm, har genomförts i samarbete med professor Bin Wu (Nanyang Technological University, Singapore), Dr Luca Rampoldi (San Raffaele Hospital) , Milan), professor Shigeki Yasumasu (Sophia University, Tokyo) och professor Hans Hebert (KTH Royal Institute of Technology, Stockholm).
Arbetet finansierades med bidrag från Vetenskapsrådet, Knut och Alice Wallenbergs stiftelse, Centret för innovativ medicin och KI Research Foundation, samt med ytterligare finansiering till de samarbetande grupperna.
