Epigenetiska mekanismer bakom makrofaginflammation upptäckt

Hur påverkar regulatoriska genomelement - såsom enhancers och silencers - genuttryck, vilka är de inblandade komponenterna, och kan vi modulera dem för framtida behandlingar? Genom att undersöka dessa grundläggande frågor i inflammatoriska makrofager har BioNut-forskare hittat några oväntade svar. Studien publiceras idag i Molecular Cell.
Eckardt Treuter, professor i molekylär cellbiologi vid Institutionen för biovetenskaper och näringslära vid KI, och hans labb har ett långvarigt intresse av att förstå de mekanistiska och fysiologiska rollerna hos transkriptionella corepressorer. Corepressorer är proteiner som interagerar med transkriptionsfaktorer och modifierar kromatin för att reglera genuttryck. Framförallt har deras studier i makrofager avslöjat några epigenetiska mekanismer som potentiellt kan ligga bakom utvecklingen av immunometabola sjukdomar, inklusive typ 2-diabetes och ateroskleros. Forskarna har sedan tidigare funnit att en underenhet av ett grundläggande corepressorkomplex, kallat GPS2, är nedreglerat i monocyter och makrofager hos människor med fetma och typ 2-diabetes. Detta påverkar antagligen corepressorkomplexet på många sätt och resulterar i förändringar av inflammatoriskt genuttryck, men de underliggande mekanistiska detaljerna har förblivit okända.
I den nu aktuella studien använde forskarna sig av en in vitro modell för inflammatorisk makrofagaktivering för att undersöka sambandet mellan kromatinstruktur, histonmodifieringar, transkriptionsfaktorer, corepressorer, RNA transkription och genuttryck.
Väsentliga för ombyggnad av kromatin
”Vår studie belyser den ganska överraskande dubbla rollen som corepressorer har på enhancers och silencers, cis-regulatoriska DNA element i genomet vilka styr genuttryck på till synes motsatta sätt”, säger Eckardt Treuter.
”Vi tror att corepressorer, tillsammans med transkriptionsfaktorerna som binder till dessa element, är väsentliga för den signalberoende kromatinombyggnaden inom definierade tredimensionella (3D) strukturer, så kallade TADs.”
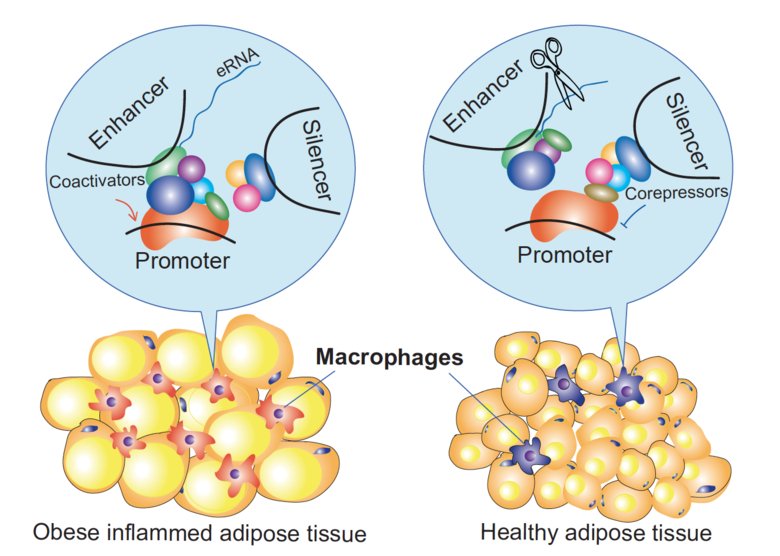
Studien visar också på nya bevis för att enhancer-transkriberade eRNAs skulle kunna ha en funktionell roll, en fråga som för närvarande är omdiskuterad inom området. Till exempel ser det ut som om corepressorer och eRNA beter sig antagonistiskt för att samtidigt reglera 3D-kromatinorganisation och genuttryck. Forskarna kunde till och med minska makrofaguttrycket av CCL2 (aka MCP-1, ett viktigt inflammatoriskt kemokin) hos möss genom att inhibera ett eRNA med en modifierad kort nukleinsyra.
"Vi är särskilt glada över att vårt arbete visar att man selektivt kan manipulera makrofag-eRNA för att minska inflammation och därigenom förbättra metabol hälsa hos överviktiga möss", säger forskarassistenten Rongrong Fan, en av huvudförfattarna.
”Det här betonar potentialen av regulatoriska genomelement såsom enhancers för att bekämpa immunometabola sjukdomar.”
Studien har genomförts i samarbete med forskare från University of Eastern Finland Kuopio, INSERM Paris, Karolinska Institutet Huddinge (Institutionen för medicin, Institutionen för laboratoriemedicin) och Trinity College Dublin.
Arbetet finansierades med bidrag från Centrum för innovativ medicin, Vetenskapsrådet, Cancerfonden, Novo Nordisk fonden, Diabetesfonden och KI forskningsfonder, samt ytterligare finansiering till de olika samarbetsgrupperna.
