Ökad förståelse av patologiska förändringar i hjärnan vid Alzheimers sjukdom
I ett samarbetsprojekt mellan Karolinska institutet, Karolinska universitets sjukhuset, Uppsala universitet och Åbo universitet under ledning av professor Agneta Nordberg NVS, KI har skillnader i patologiska förändringar studerats med PET ligander i hjärnvävnad hos olika ärftliga former av Alzheimers sjukdom jämfört med sporadisk Alzheimer.
Resultaten publiceras i Molecular Psychiatry och visar att förekomst av de välkända amyloida placken vid Alzheimers sjukdom inte tycks vara nödvändiga för inlagring av tau protein och inflammatoriska förändringar i hjärnan under sjukdomsförloppet för Alzheimers sjukdom. Forskningsresultaten kan ha betydelse för fortsatt läkemedelsutveckling.
Denna studie fokuserar på en ökad förståelse av de karaktäristiska patologiska förändringar i hjärnan vid AD såsom inlagring av amyloida plack och tau och inflammatoriska processer (astrocytos), berättar Laetitia Lemoine försteförfattare till publikationen. Vår forskning syftar till en ytterligare förståelse av de patologiska processerna vid Alzheimers sjukdom (AD), den vanligaste formen av neurodegenerativ sjukdom och demens.
Vi gör detta genom att studera bindningen av olika PET imaging biomarkörer till postmortal hjärnvävnad. AD betraktas i flesta fall vara sporadiskt förekommande och AD som orsakats av genetiska autosomal dominanta mutationer (ADAD) representerar endast några få procent. En viktig frågeställning är om ADAD kan användas som modell för sporadisk AD? I denna aktuella studie undersökte vi hjärnor från AD patienter tillhörande familjer med kända AD mutationer nämligen nämligen AßPParc (arktiska) mutationen respektive PSEN1DE9 mutationen. I båda fallen påvisas i hjärnvävnaden avvikande amyloid plack som kan karakteriseras genom immuno färgning: APPParc med ringformade plack utan tät amyloidkärna och PSEN1DE9 med sk diffusa bomulls plack (cotton wool plaque).
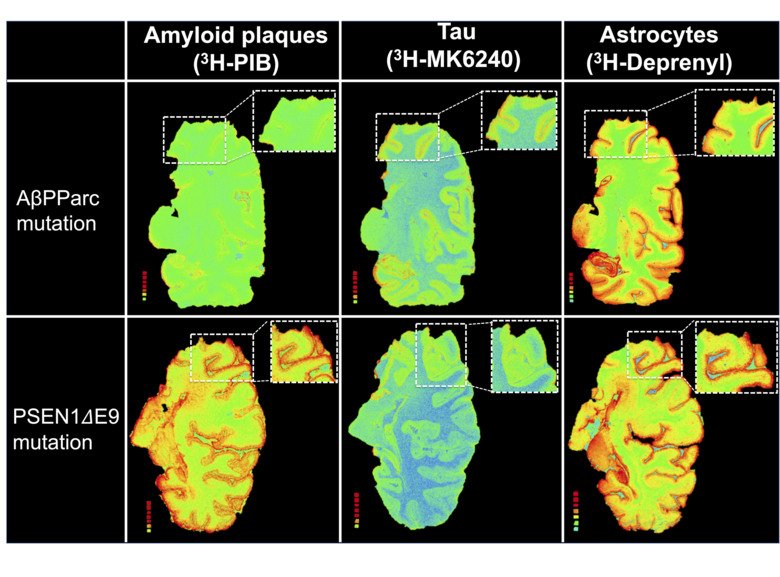
Studien inkluderar hjärnvävnad från två bärare av AßPParc-mutationer, en bärare med PSEN1DE9-mutation samt AD patienter med icke ärftlig form. Vi observerade ingen specifik bindning av amyloid PET-tracern PIB i AßPParc-hjärnvävnad medelst autoradiografi på stora tunna hjärnsnitt medan det däremot uppmättes en hög bindning av PIB tracer i PSEN1DE9 hjärnvävnad också i jämförelse med sporadisk AD. Dessa resultat är i linje med PET undersökningar som utförs på levande patienter. För andra biomarkörer förelåg i båda formerna av ADAD och sporadisk AD en hög regional bindning i hjärnvävnad av tau PET tracer THK5117 och MK6240 samt tracer Deprenyl (astrocyter). En positiv korrelation observerades mellan deprenyl bindning (astrocyter) och THK5117 (tau) bindning i olika regioner av AßPParc- hjärnvävnad medan ingen korrelation förelåg i PSEN1DE9 eller sporadisk AD vävnad .
Vår studie visar skillnader i egenskaperna hos amyloida plack mellan två genetiska varianter av AD och sporadisk AD. Det är intressant att notera att trots avsaknad av mätbar förekomst av amyloida plack med PET tracer PIB observerades hög tau- och astrocyt-PET-tracer bindning i AßPParc hjärnvävnad. Denna studie visar att förekomst av de klassiska histopatologiska amyloida placken synes inte nödvändig för utveckling av tau och inflammatorisk patologi under sjukdomsförloppet av AD. Detta är en viktig observation att beakta vid framtida läkemedelsutveckling vid AD. Den något olika patologiska kaskad av förändringar som observerades vid AβPParc jämfört med PSEN1DE9 varianter av AD motiverar till fortsatt forskning.
Publikation
Laetitia Lemoine, Per-Göran Gillberg, Nenad Bogdanovic, Inger Nennesmo, Laure Saint-Aubert, Matti Viitanen, Caroline Graff, Martin Ingelsson, Agneta Nordberg. Amyloid, tau and astrocyte pathology in autosomal dominant Alzheimer’s disease variants: AβPParc and PSEN1DE9. Molecular Psychiatry 25 juni 2020.
Anslag
Forskningen har finansierats med anslag från Stiftelsen för Strategisk forskning (SSF) Vetenskapsrådet, KI /Stockholms läns landsting, Hjärnfonden,Alzheimer fonden,CIMED, Stiftelsen GamlaTjänarinnor,Demensfonden,Loo och Hans Ostermans fond,Tore Nilsson fond, Gunvor och Josef Aners stiftelse, KI fond för geriatrisk forskning.
