Nya insikter om de molekylära mekanismerna bakom stressreaktioner vid PTSD

Ett internationellt forskarlag, under ledning av Tibor Harkany och Robert Schnell vid Karolinska Institutet och MedUni Vienna's Center for Brain Research, har sökt efter mekanismer för att minska stressreaktionerna vid posttraumatiskt stressyndrom. I deras omfattande tester fann de sekretagogin och kunde visa att denna molekyl reglerar frisättningen av CRH, ett hjärnhormon som kontrollerar stressaxeln.
I den aktuella studien påvisade forskarna att sekretagogin, ett kalciumsensorprotein som förekommer i stora mängder vid synapser, samverkar med två nyckelproteiner i frisättningsmaskineriet ("SNARE"). De har identifierat nya partners för sekretagogin. Den nya partnern, syntaxin-4, krävs för att vesiklerna ska kunna röra sig mot frisättningsstället. Den andra, tidigare kända partner, snap-25, ett protein också integrerat i SNARE-komplexet. Sekretagogin binder snap-25 med en högre affinitet än syntaxin-4.
– Dessa resultat är viktigta eftersom secretagogin kan "lämna över" syntaxin-4-märkta fraktvesikler till ett aktiverat snap-25 och därmed främjar frisättningen av hormon/transmittorer, säger Robert Schnell, docent vid institutionen för neurovetenskap vid Karolinska Institutet.
Dessa resultat får stöd av analyser av möss som genom genetisk manipulation saknar sekretagogin. I dessa knock-out möss är hormonfrisättningen starkt försämrad. Denna princip är av stor betydelse eftersom sekretagogin är uttryckt i många viktiga vänader/organ, inte bara i hypotalamus utan även, till exempel, i de insulin-producerande beta-cellerna in bukspottkörteln. Sålunda är sekretagogin inkopplat i flera livsviktiga processer och är därmed en potentiell måltavla för läkemedelsutveckling.
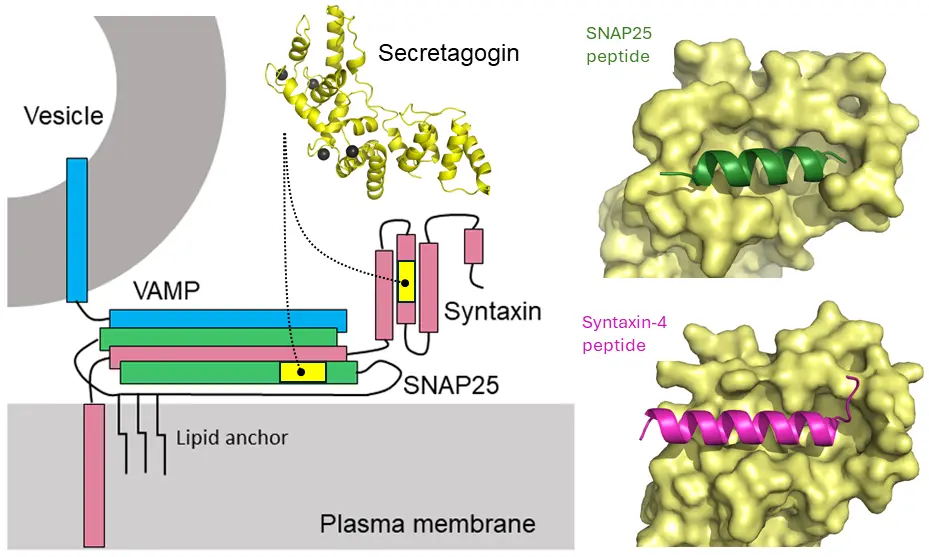
Forskarteamet använde proteinkemi, strukturell biologi och cellulära modeller för att utföra studien. Strukturerna för tre proteinkomplex bestämdes med röntgenkristallografi.
Nästa steg
Våra studier påvisar en ny princip för läkemedelsutveckling, där vi vill identifiera små molekyler som påverkar hastigheten för hormonfrisättning i specifika cellsystem.
Studien finansierades huvudsakligen via ett ERC ”Proof-of-Concept”-anslag samt Novo Nordisk fonden.
Publikation
A hydrophobic groove in secretagogin allows for alternate interactions with SNAP-25 and syntaxin-4 in endocrine tissues.
Szodorai E, Hevesi Z, Wagner L, Hökfelt TGM, Harkany T, Schnell R
Proc Natl Acad Sci U S A 2024 Apr;121(16):e2309211121
