Molekylär video visar hur cellens kraftverk städas
Forskare vid Karolinska Institutet har skapat en slags molekylär video som visar hur ett viktigt enzym i mitokondrier bryter ner RNA som inte längre behövs. Studien, som publiceras i Nucleic Acids Research, ger ny förståelse för varför vissa genmutationer orsakar hörselnedsättning och neurologiska sjukdomar.
Mitokondrier är cellens kraftverk och beroende av välfungerande RNA för att bygga proteiner och producera energi. När RNA blir skadat eller inte längre behövs måste det brytas ner, annars riskerar mitokondriernas funktion att störas. Ett enzym som spelar en central roll i denna process är humant polynukleotidfosforylas (hPNPase). Om enzymet inte fungerar som det ska kan det leda till neurologiska störningar och hörselnedsättning.
Forskare vid Karolinska Institutet har nu lyckats ta fram detaljerade strukturer av enzymet i tre olika arbetsstadier – från att RNA binds till att det bryts ner.
Visar hur enzymet arbetar
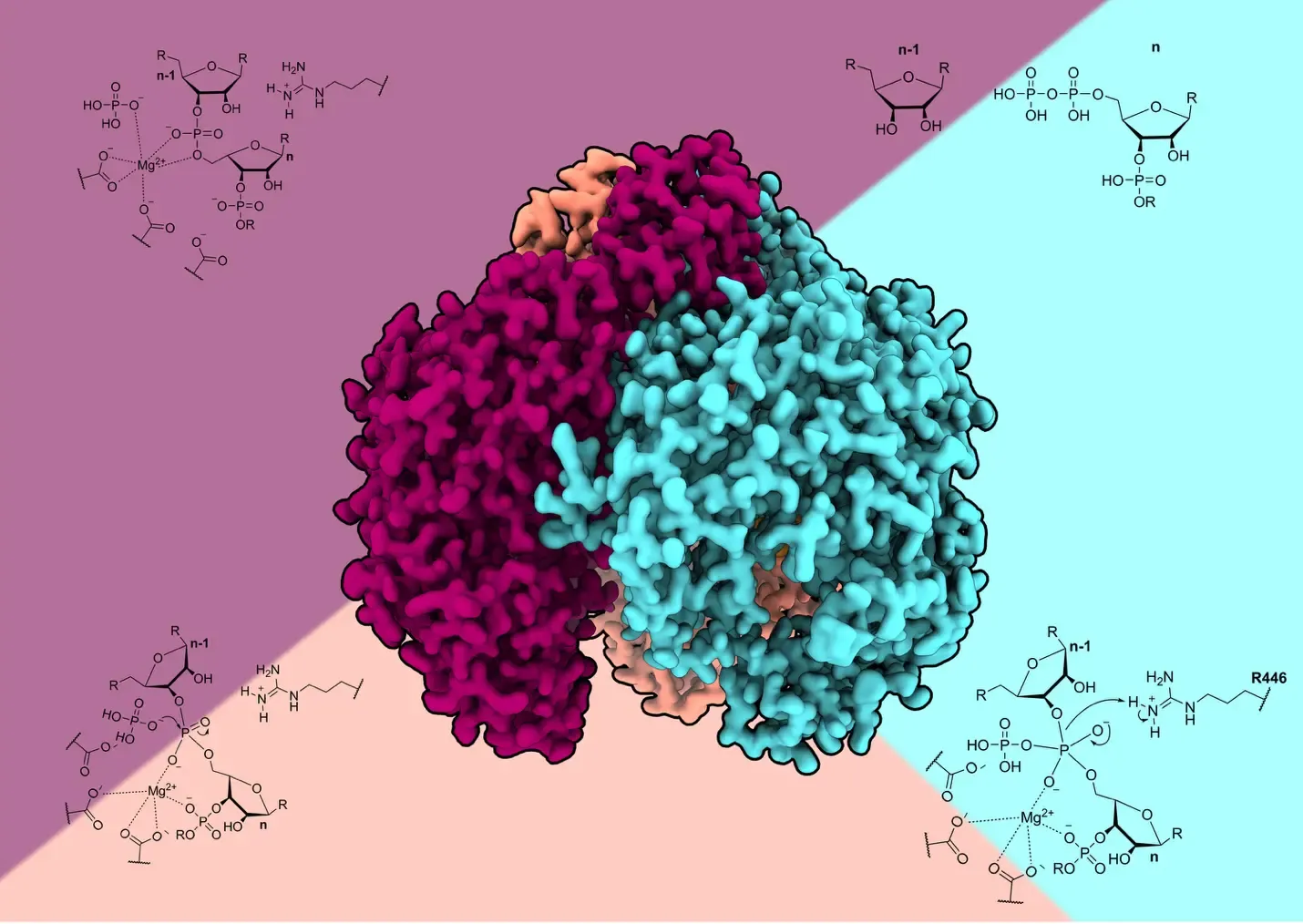
Med hjälp av kryoelektronmikroskopi har forskarna skapat en slags molekylär video – en serie ögonblicksbilder som visar hur enzymet arbetar i två steg. Först binds RNA i en U-formad struktur som förhindrar för tidig klyvning.
Därefter roteras de två yttersta byggstenarna i RNA, vilket gör att enzymet kan klippa av fosfatbindningen. En magnesiumjon fungerar som katalysator och stabiliserar reaktionen.

– Vi blev förvånade över att RNA:s ändar vrids 180 grader innan klyvning sker. Det är en elegant lösning för att undvika felaktig nedbrytning, säger studiens försteförfattare Ole Unseld, doktorand på institutionen för cell- och molekylärbiologi vid Karolinska Institutet.
Studien visar också att RNA inte tar sig in genom enzymets centrala por, som man tidigare trott, utan via en öppning i botten. Denna insikt förklarar varför den mänskliga varianten skiljer sig från enklare bakterieenzymer. Skillnaderna gör att hPNPase kan hantera skadat RNA och producera små fragment snarare än enskilda byggstenar.
Fångar kortlivade tillstånd
För att fånga olika stadier i den katalytiska cykeln använde forskarna strategiska biokemiska metoder. För laddningsstadiet använde de RNA-substrat med fosforotioatmodifieringar som bromsar men inte stoppar klyvningen. För det prekatalytiska stadiet ersatte de fosfat med sulfat, vilket binder i det aktiva centrumet men inte kan stödja katalys.
– Detta projekt krävde noggrann stabilisering av reaktionens intermediära tillstånd så att vi kunde se distinkta steg istället för ett genomsnitt. Att integrera kryo-EM med biokemi var avgörande för att fastställa rollerna för Mg²⁺-jonen och Pi samt beskriva sekvensen av konformationsförändringar under RNA-bindning och katalys, säger Hrishikesh Das, andraförfattare och forskningsspecialist på samma institution.
RNA-masspektrometri kompletterade det biokemiska och strukturella arbetet och visade att hPNPas främst frigör dinukleotidprodukter från RNA:s 3'-ände, med trinukleotider som minsta produktlängd. Detta processivitetsmönster skiljer sig från bakteriella enzymer och speglar de strukturella begränsningarna i det mänskliga enzymets aktiva centrum.
Kan orsaka allvarlig sjukdom
Kunskapen är viktig eftersom mutationer i genen PNPT1, som kodar för hPNPase, kan orsaka allvarliga sjukdomar som Leighs syndrom, hörselnedsättning och störningar i cellens energiproduktion. Genom att veta vilka delar av enzymet som är avgörande för funktionen kan läkare bättre bedöma om en mutation är sjukdomsorsakande.
– Våra strukturer ger en karta över vilka aminosyror som är kritiska. Det kan hjälpa kliniker att tolka genetiska testresultat och ge bättre rådgivning till drabbade familjer, säger Martin Hällberg, senior forskare vid institutionen för cell- och molekylärbiologi, Karolinska Institutet.
Forskarna planerar nu att studera hur hPNPase samarbetar med andra proteiner i mitokondrierna. Studien har finansierats av Knut och Alice Wallenbergs Stiftelse och Vetenskapsrådet. Inga intressekonflikter har rapporterats.
Publikation
Loop-mediated regulation and base flipping drive RNA cleavage by human mitochondrial PNPase Open Access Ole Unseld, Hrishikesh Das, B Martin Hällberg, Nucleic Acids Research, online 9 december 2025, doi: 10.1093/nar/gkaf1296.
